1. Dominando mTOR para longevidade e desempenho
Este artigo é sobre Mammalian Target of Rapamicina ou mTOR. É um conceito importante para a saúde e longevidade.
O que é o alvo mamífero da rapamicina (mTOR)
Alvo Mecanístico da Rapamicina ou Alvo Mamífero da Rapamicina mTOR é um sensor de combustível de proteína quinase que monitora as estatísticas de energia de suas células [1] . Está envolvido em todos os aspectos da vida e existência celular.
Existem 2 complexos mTOR – mTORC1 e mTORC2. Eles estimulam o crescimento celular, a proliferação, o reparo do DNA, a síntese de proteínas, a angiogênese, a construção muscular, o sistema imunológico e tudo relacionado ao anabolismo [2] .
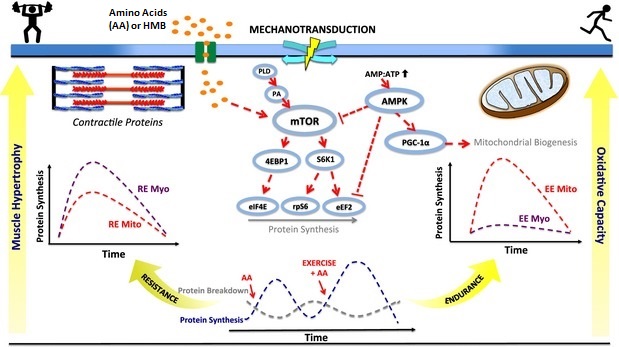
- O mTORC1 funciona como um sensor de nutrientes que controla a síntese de proteínas [3] . mTORC1 é regulado por insulina, fatores de crescimento, aminoácidos, estímulos mecânicos, estresse oxidativo, níveis de oxigênio, presença de moléculas de energia (ATP), ácido fosfatídico e glicose [4] . É um fator chave na síntese de proteínas do músculo esquelético [5] .
- As funções do mTORC2 regulam o citoesqueleto de actina , que é uma rede de longas cadeias de proteínas no citoplasma de células eucarióticas [6] . Também fosforila a atividade do receptor IGF-1 através da atividade do aminoácido tirosina proteína quinase [7]
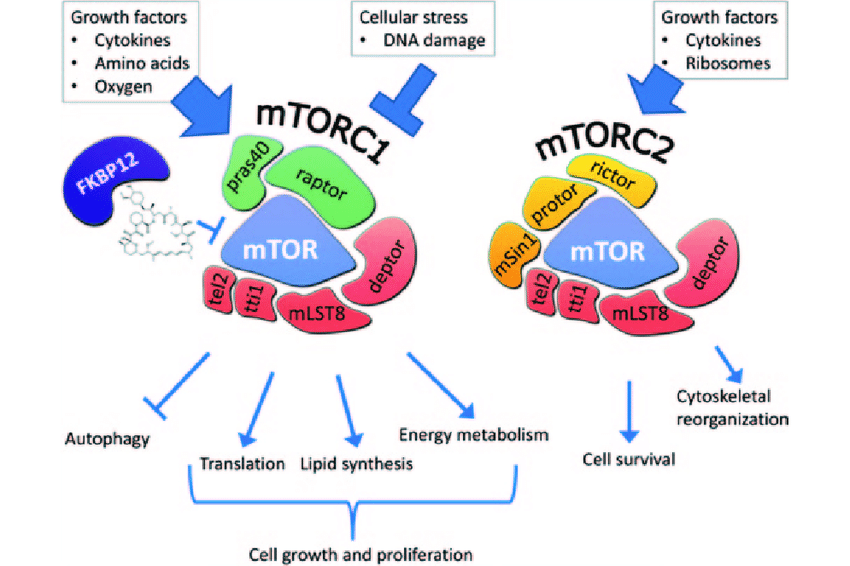
mTOR está envolvido com vias anabólicas, como insulina, fatores de crescimento semelhantes à insulina (IGF-1 e IGF-2) e aminoácidos [8] [9] .
Descoberta do mTOR
A história de como o mTOR foi descoberto também é uma história bastante interessante.
Em 1975, os cientistas estavam coletando bactérias do solo nas ilhas do Pacífico. Na Ilha Oriental, eles descobriram que essas bactérias Streptomyces hygroscopicus secretavam um composto específico com poderosos efeitos imunossupressores. Eles nomearam o composto Rapamicina após o nome polinésio da ilha Rapa Nui.
Durante a década de 1990, descobriu-se que a rapamicina se liga a um certo complexo de proteínas nas células. Essa proteína foi batizada de mTORC1 – nossa amiga mTOR aqui. No entanto, a rapamicina não se liga a mTORC2 [10] .
O mTORC1 detecta muitos sinais extra e intracelulares e fatores de crescimento [11] , enquanto o mTORC2 é conhecido por ser ativado apenas por fatores de crescimento [12] . Fatores de crescimento seriam coisas como insulina, estímulo muscular mecânico, enquanto fatores nutrientes seriam coisas como aminoácidos e glicose que promovem fatores de crescimento como insulina e IGF-1.
Após vários estudos, descobriu-se que o mTOR funciona como um botão liga e desliga para o crescimento celular.
Simplificando, se o mTOR detecta energia no corpo, ele regula positivamente os processos relacionados ao crescimento e à produção de ATP.
O caminho mTOR
Aqui está o caminho mTOR explicado de forma simples:
- Sempre que seu corpo detectar excesso de energia no sistema, ele tentará direcioná-la para os lugares certos.
- Os complexos mTOR são ativados por fatores de crescimento, principalmente insulina e IGF-1, mas também fatores nutrientes como aminoácidos e proteínas.
- O Receptor de Insulina (IR) e o Receptor de IGF-1 (IGF-1R) estão na classe dos receptores de tirosina quinase. Tirosina é um aminoácido. A ativação desses receptores leva à fosforilação das proteínas receptoras do substrato da insulina (IRS) [13] .
- O IRS ativa uma proteína chamada fosfatidilinositol-3-quinase (PI3K), que fosforila ainda mais os fosfolipídios inositol como o PIP3. PIP3 interage com as proteínas PDK1 e Akt.
- Akt é considerado um dos principais reguladores upstream do mTOR [14] . Akt é uma família de proteínas que compreende Akt1, Akt2 e Akt3. Akt1-2 são expressos no músculo esquelético, enquanto Akt3 não é [15] .
- Akt inibe a quebra de proteínas regulando a família de proteínas FoxO. As proteínas FoxO regulam a quebra de proteínas e as vias relacionadas à autofagia [16] . Eles são inibidos por Akt, que previne a morte celular [17] .
- Quando há muitos nutrientes ao redor, o mTORC1 se liga ao ULK1, que é uma quinase ativadora da autofagia e inibe a formação de autofagossomos que iniciariam a autofagia [18] . Quando a energia se esgota, o mTORC1 torna-se inativo e se libera do complexo ULK1, liberando assim a formação de autofagossomos.
A miostatina é um fator de crescimento que inibe o crescimento muscular suprimindo a hipertrofia [19] . É basicamente a tentativa do seu corpo de não construir muitos músculos como forma de preservar a energia de uma perspectiva evolutiva. A miostatina reduz a atividade de Akt/mTORC1/p70S6K e a síntese de proteínas, o que bloqueia a cópia das células musculares [20]
AMPK, mTORC1 e ULK1 formam a Tríade Quinase, que mantém a homeostase de energia e nutrientes [21] . Essas proteínas quinases e sensores de combustível estão em constante correlação entre si e se equilibram com base nas condições energéticas do corpo.
O que ativa o mTOR
A regulação do mTOR é mediada principalmente pela quinase ativada por AMP (AMPK). A AMPK monitora o estado de energia das células por meio de seu conteúdo de glicogênio e as proporções de ATP para AMP para ADP. Uma redução na energia ativa a AMPK, que promove vias catabólicas para manter a homeostase energética [22] . AMPK inibe o crescimento muscular suprimindo mTORC1.
Aqui estão os outros nutrientes e fatores ativadores do mTOR:
- Os aminoácidos promovem a atividade do mTORC1 [23] sem afetar a atividade do mTORC2 [24] . A leucina ativa especificamente o mTORC1 mais [25] . Algumas evidências também sugerem que o subproduto da leucina, HMB, pode ter um efeito anabólico semelhante através da via de sinalização do mTORC1 [26]
- Estímulos mecânicos do exercício resistido, especialmente contrações excêntricas, aumentam os níveis de mTORC1 [27] . O ácido fosfatídico é regulado pelo exercício que ativa o mTORC1 [28]
- O ácido ursólico estimula mTORC1 após treinamento de resistência em camundongos [29] . Estimula o anabolismo através das vias PI3K/Akt
- A creatina pode potencialmente promover o mTORC1 aumentando a atividade do IGF-1 após o exercício , mas não potencializa ainda mais o mTORC1 várias horas após o exercício [30]
- O ácido fosfatídico aumenta a sinalização mTOR e a hipertrofia induzida por exercícios de resistência [31]
- Testosterona e andrógenos também podem sinalizar mTOR e induzir hipertrofia muscular [32] [33]
Esses nutrientes e sinais de crescimento são captados por receptores na superfície das células, como os receptores de insulina, e pela disponibilidade de energia em toda a matriz celular por meio da AMPK e suas proporções ATP:AMP:ADP.
mTOR e Câncer
A superexpressão de mTOR ou sua disfunção é frequentemente relacionada a vários tipos de câncer e distúrbios genéticos [34] . A supressão do mTOR com dieta ou certos suplementos como metformina e rapamicina são formas comuns de tratar o câncer e o crescimento do tumor.
- A rapamicina inibe mTORC1, que é pensado para aumentar a expectativa de vida em estudos com animais.
- Interromper o mTORC2 com Rapamicina pode induzir resistência à insulina e sintomas de diabetes e intolerância à glicose [35]
O aumento da glicólise, que é o metabolismo da glicose em lactato, é frequentemente encontrado em células cancerígenas, também conhecido como Efeito Warburg [36] . Em 1924, Otto Warburg descobriu que as células tumorais cancerígenas atendem principalmente às suas demandas de energia a partir da glicólise. Akt regula Hexokinase 2, que é pensado para causar esta glicólise aumentada em células cancerígenas. mTOR promove a ativação de receptores de insulina e receptores de fator de crescimento semelhante à insulina 1 (IGF-1) [37] [38] , que é na maioria dos casos acompanhado por glicose e glicólise.
A inibição do mTOR também promove a autofagia , que é a via catabólica de reciclagem e renovação celular. A alta atividade de mTOR pode promover o crescimento do tumor por impedir a autofagia de remover células cancerígenas [39] .
Pacientes com doença de Alzheimer também apresentam atividade mTOR desregulada no cérebro e conexão com proteínas beta-amilóides. [40] [41]
mTOR e Envelhecimento
Verificou-se que a redução da expressão de mTOR aumenta o tempo de vida em diferentes espécies de leveduras, bactérias e camundongos [42] [43] [44] .
A restrição de metionina também pode ser benéfica para a longevidade. SAM (S-Adenosil-Metionina) é o segundo cofator mais comum em enzimas depois do ATP, que detecta a presença de nutrientes relacionados à metionina no corpo. Um dos sensores de metionina SAMTOR (S-adenosilmetionina a montante de mTORC1) inibe a sinalização de mTORC1. A restrição de metionina reduz o SAM e aumenta o SAMTOR, o que melhora a homeostase da glicose e pode promover a longevidade nos mesmos moldes da restrição calórica.
Uma das razões pelas quais se pensa que a restrição de calorias e metionina prolonga a vida é devido à diminuição do mTOR [45] .
Por causa de seus potentes efeitos anabólicos de crescimento, a sinalização mTOR durante o início da vida é muito benéfica e necessária para o desenvolvimento adequado. No entanto, pode não ser ideal à medida que você envelhece.
Uma das teorias por que as pessoas envelhecem e morrem é por causa da degradação mitocondrial. A teoria dos radicais livres do envelhecimento afirma que as espécies reativas de oxigênio (ROS) e o estresse oxidativo danificam as mitocôndrias, o que diminui a produção de ATP [46] . Ao diminuir o mTOR, você preserva o ATP que, de outra forma, seria usado para a síntese de proteínas. A sinalização baixa de TOR também aumenta a autofagia, o que ajuda a remover ROS e reciclar células velhas de volta à energia, retardando assim o envelhecimento.
O mTOR pode promover inflamação intestinal [47] , bem como acne na pele [48] , o que é mais uma prova de como o mTOR alto acelera o envelhecimento.
Exemplos de Inibidores mTOR
Veja como são os mecanismos do mTOR Inhibitor:
- A restrição de proteína dietética reduz mTOR [49] . A deficiência de aminoácidos, em particular, regula mTOR [50]
- A restrição calórica diminui o mTOR e promove a autofagia [51] . A grelina, o hormônio da fome, ativa a AMPK no hipotálamo e inibe o mTOR [52]
- O jejum reduz a glicose, a insulina e suprime a mTOR enquanto aumenta a AMPK. Este é o método mais eficaz de inibir mTOR. Também aumenta a autofagia e promove a cetose. É uma boa ideia estender jejuns por 3 a 5 dias algumas vezes ao ano para reduzir mTOR e aumentar a autofagia para prevenção de doenças.
- As dietas cetogênicas são moderadas em proteínas e com baixo teor de glicose, o que reduz a atividade do mTOR [53] . O glucagon, que é um hormônio que aumenta na presença de baixa glicose e insulina, ativa a AMPK e reprime o mTOR [54]
- O exercício inibe o mTORC1 no fígado e nas células adiposas [55] . Isso é ótimo porque você estará evitando o ganho de gordura enquanto promove a longevidade e o crescimento muscular.
- Os glicocorticóides e o cortisol aumentam durante o estresse fisiológico [56] . O cortisol ajuda a mobilizar glicogênio e ácidos graxos.
- A metformina é um potente medicamento antidiabético que reduz o açúcar no sangue e a insulina, diminuindo assim o mTOR [57] . Berberina é um composto medicinal que tem efeitos semelhantes
- A rapamicina é uma droga imunossupressora que reduz mTOR [58] . Tem sido usado para combater cânceres e tumores em humanos.
- O resveratrol é um composto encontrado em certas frutas e vinho tinto que tem um efeito de aumento da longevidade [59]
- A curcumina inibe a sinalização mTOR em células cancerígenas [60] . Reishi também combate tumores bloqueando mTOR [61] . Rhodiola rosea [62] e astrágalo também [63] .
- As antocianinas encontradas em mirtilos e extrato de semente de uva promovem AMPK e bloqueiam mTOR [64] . Romã também [65]
- O álcool ativa a AMPK e regula o complexo mTOR [66] . Isso não quer dizer que beber vai aumentar sua longevidade. Lembre-se de que a inibição do mTOR é apenas uma peça do quebra-cabeça.
- O ácido oleanólico contribui para a atividade antitumoral [67] . As principais fontes alimentares de ácido oleanólico são maçãs, romãs, mirtilos, limões, uvas, mirtilos e azeitonas.
- A carnosina inibe a proliferação de células cancerígenas de carcinoma gástrico humano, retardando a sinalização mTOR [68] . A carnosina é um aminoácido com benefícios antienvelhecimento e antioxidantes.
Embora existam algumas evidências mostrando como mTOR pode ter efeitos colaterais negativos, ainda é um caminho essencial para o crescimento e manutenção celular. Então, o mTOR é ruim para você?
Benefícios do mTOR
Aqui está o lado leve do TOR:
- mTOR é necessário para a síntese de proteínas e hipertrofia do músculo esquelético [69] . Suprimir o mTOR por muito tempo ou ter muita autofagia leva à atrofia muscular e à perda de tecido magro por meio da sarcopenia, o que pode contribuir para o envelhecimento e distúrbios metabólicos [70] .
- O mTORC2 regula a distribuição das mitocôndrias e o AKT ativado por mTORC2 está ligado à proliferação mitocondrial [71] [72] . mTOR também promove a biogênese mitocondrial ativando PGC1-alfa [73] .
- O mTORC2 localiza o retículo endoplasmático (ER) associado à mitocôndria e a membrana associada à mitocôndria (MAM) [74] . Essa localização é estimulada pelos fatores de crescimento PI3K.
- A deficiência de mTORC2 causa um defeito no MAM, que causa uma absorção de cálcio nas mitocôndrias.
- mTOR também pode ajudá-lo a perder peso e ser mais saudável . mTORC2 regula a homeostase da glicose via Akt. Akt promove a captação de glicose aumentando a translocação de GLUT4 para a membrana nos adipócitos [75] . O mesmo efeito também é verdadeiro por causa do aumento da massa muscular e da sensibilidade à insulina que é acompanhada pelo músculo. Se você tiver mTOR muito baixo, não será capaz de construir músculos , tendo assim uma flexibilidade metabólica mais pobre e, na verdade, predispondo-se a doenças.
- O mTOR também contribui para a plasticidade neural e o desenvolvimento da memória de aprendizagem [76] . A neuroplasticidade é um fator chave para a aprendizagem, aquisição de habilidades e retenção de memória. Parece que tanto níveis muito baixos de mTOR quanto superexpressão de mTOR causam prejuízo no aprendizado e declínio cognitivo. A ativação de mTOR em neurônios pré-frontais por HMB inibe o declínio cognitivo relacionado à idade em animais [78] . mTOR também ajuda a aumentar as conexões sinápticas.
Em suma, a sinalização mTOR parece ser mais problemática em pessoas que já têm uma determinada doença, como câncer, tumores, diabetes ou Alzheimer . A razão é que o mTOR inibe a autofagia, o que ajudaria a combater a doença, eliminando as células doentes. Se você estiver doente e continuar estimulando os fatores de crescimento no corpo, continuará alimentando a doença ao mesmo tempo em que interromperá os processos de cura. É por isso que o jejum rigoroso por um longo período de tempo parece ajudar a tratar muitas doenças e cânceres.
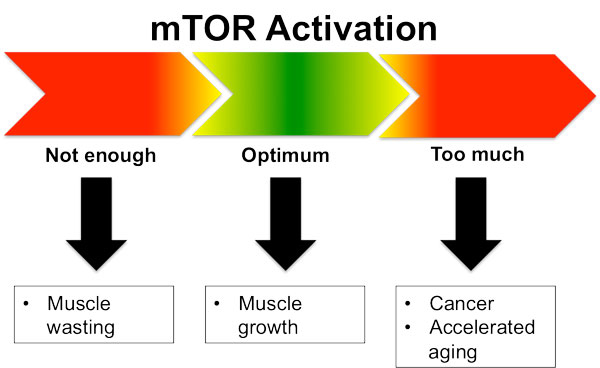
Quanto mTOR é demais?
O mTOR tem seus benefícios para o desempenho, bem como alguns aspectos de suporte para a longevidade. No entanto, não é ideal tê-lo elevado o tempo todo por razões óbvias. É por isso que saber como pedalar o mTOR é vital para a longevidade.
Você deseja ativar mTOR em células musculares, células cerebrais e mitocôndrias, em vez de células de gordura e células cancerígenas.
- O exercício ativa o mTOR no cérebro e promove o mTOR no músculo esquelético [78] . O treinamento de resistência, em particular, fará com que você construa músculos por meio dos estímulos mecanísticos do mTOR.
- A restrição de tempo para comer é provavelmente a coisa mais eficaz e crítica para controlar o mTOR. Mesmo que você esteja comendo uma dieta mTOR baixa, você também precisa de autofagia se quiser promover a longevidade. Muito ou pouco de qualquer um é algo que você deseja evitar. É por isso que equilibrar esses caminhos ao longo do dia é o que vai lhe proporcionar uma longevidade ideal.
- Se você está jejuando por longos períodos de tempo e está comendo com menos frequência, então você precisa tornar suas refeições mais estimulantes mTOR para contrabalançar os efeitos catabólicos do jejum e apoiar a homeostase muscular
- Se você está jejuando menos e comendo com frequência, é realmente uma ideia melhor manter seus alimentos com menos mTOR
Cronometrar a ativação do mTOR é provavelmente o componente mais crítico para isso.
Temporização da ativação do mTOR
Se seu objetivo é saúde e longevidade, você não quer ser anabolizante o dia todo. Isso inibirá a autofagia e pode simplesmente favorecer a proliferação da doença.
Você deseja ativar o mTOR apenas para anabolismo positivo, como crescimento muscular, neurônios cerebrais e mitocôndrias.
É por isso que eu diria que a melhor estratégia é manter um estado de baixo mTOR a maior parte do dia em jejum e depois estimulá-lo em um ambiente pós-treino . Isso garante que você ativará o mTOR por seus efeitos benéficos. Se você está aumentando o mTOR sem precisar reparar seu corpo, inevitavelmente será pior para a longevidade do que se você o fizesse após o exercício.
Devido ao mesmo raciocínio, ativar o mTOR após acordar não é ideal porque seu corpo está em um estado de cetose mais profunda e autofagia leve após o jejum noturno. mTORC1 promove o armazenamento de ácidos graxos inibindo a lipólise [79] . Também inibe a beta-oxidação e a cetogênese [80] .
Ligar o mTOR imediatamente pode impedir que você volte à autofagia pelo resto do dia. A autofagia melhora a sensibilidade à insulina e é necessária para manter a sensibilidade à glicose e o funcionamento das células beta quando sob condições de dietas ricas em gordura [81]
Mais mTOR aumenta mais o quê?
Outro benefício de restringir a ativação do mTOR é que você evitará os efeitos colaterais negativos da elevação crônica do mTOR. Na minha opinião, todas as associações de mTOR com câncer e envelhecimento decorrem de tê-lo elevado o tempo todo, como a dieta brasileira padrão 3 vezes ao dia ou a dieta de fisiculturista rica em proteínas com 4-6 refeições por dia.
mTOR não é como um catalisador de energia que aumenta progressivamente, o que significa que você não vai continuar crescendo mais e mais células com base na quantidade de proteínas ou carboidratos que você comeu em uma refeição. O mTOR é mais como um interruptor que abre a válvula para muitos outros hormônios anabólicos a montante que apoiam o crescimento de tecidos e a proliferação celular. Se você tiver a válvula aberta o tempo todo, ela simplesmente liberará mais desses hormônios de crescimento no corpo, onde eles continuarão construindo tudo o que puderem, incluindo o bom e o ruim.
Não importa o quanto você restrinja proteínas ou carboidratos, porque mesmo pequenas quantidades de aminoácidos e energia ativarão o mTOR até certo ponto. Isso terá um efeito menor em quanto crescimento acontece, mas ainda é ativado e, portanto, inibe a autofagia e os processos catabólicos, o que contrabalançaria o mTOR e realmente forneceria os mecanismos essenciais para aumentar a longevidade.
Se o mTOR for suprimido na maioria das vezes, como durante o jejum, isso permitirá que a autofagia realmente entre em ação, dando a você os outros benefícios de aumentar a vida útil. É muito mais eficaz e fácil jejuar e, em seguida, estimular o mTOR apenas dentro de um período de tempo muito curto.
Jejum intermitente e mTOR
É por isso que acredito que um estilo de vida focado no jejum é uma das maneiras mais definitivas e seguras de promover sua longevidade. Aumenta a expectativa de vida em quase todas as espécies e tem outros benefícios metabólicos.
Fazer jejum intermitente todos os dias, pelo menos de alguma forma ou forma, permite que você fique em um estado de mTOR zero e autofagia ativada na maior parte do tempo. Quando você come, de preferência pós-exercício, você estimula mTOR bastante para promover a recuperação e contrabalançar o catabolismo com o anabolismo.

Eu diria que é muito mais ideal para a saúde e a longevidade ter um único grande pico de mTOR e síntese de proteínas VS pequenos e frequentes blips de mTOR ao longo do dia porque
- Essas pequenas manchas não vão fazer você construir nenhum músculo
- você ainda terá que restringir suas proteínas e calorias para esperar maior longevidade
- restringir demais suas calorias e proteínas levará à perda muscular e, portanto, promoverá o envelhecimento e
- um único pico alto de mTOR fará com que você construa músculos o suficiente e, em seguida, o ajude a voltar ao estado de autofagia mais rapidamente no dia seguinte
Eu mesmo jejuo cerca de 20 horas todos os dias e consegui construir músculos com isso. Sem problemas de pele, sem problemas de saúde, sem distúrbios intestinais, sem sinais de declínio cognitivo, função mitocondrial sobrecarregada, energia o dia todo, sem fome e vitalidade total.
Provavelmente existem várias maneiras de pedalar mTOR e tal, mas a idéia principal é que você tem que saber equilibrar essas vias anabólicas e catabólicas . Você pode jejuar em diferentes intervalos de tempo ou em diferentes ciclos de uma semana, mas ainda é melhor se concentrar mais em uma extremidade ou outra sem ficar em algum lugar na zona blimpy de ainda ter pequenas quantidades de mTOR, mas não estar em autofagia.
Se você quiser saber como seguir um estilo de vida autofágico que incorpore dieta, exercícios e outros biohacks para aumentar a longevidade, confira meu PROGRAMA DE AUTOFAGIA METABÓLICA, disponível em breve.
Referências
[1] https://www.ncbi.nlm.nih.gov/pubmed/22125056
[2] https://linkinghub.elsevier.com/retrieve/pii/S0092867406001085
[3]https://www.cell.com/cell/fulltext/S0092-8674(02)00808-5?_returnURL=https%3A%2F%2Flinkinghub.elsevier.com%2Fretrieve%2Fpii%2FS0092867402008085%3Fshowall%3Dtrue
[4] https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4774173/
[5] https://www.ncbi.nlm.nih.gov/pubmed/22509811/
[6]https://www.cell.com/current-biology/fulltext/S0960-9822(04)00471-3?_returnURL=https%3A%2F%2Flinkinghub.elsevier.com%2Fretrieve%2Fpii%2FS0960982204004713%3Fshowall%3Dtrue
[7] https://www.nature.com/articles/cr2015133
[8] http://genesdev.cshlp.org/content/18/16/1926
[9] https://www.sciencedirect.com/science/article/pii/S0006291X03023465?via%3Dihub
[10] https://www.ncbi.nlm.nih.gov/pubmed/15268862
[11] https://www.ncbi.nlm.nih.gov/pubmed/27534530
[12] https://www.ncbi.nlm.nih.gov/pubmed/24556838
[13] https://www.ncbi.nlm.nih.gov/pubmed/1332046/
[14] https://www.ncbi.nlm.nih.gov/pubmed/17095929/
[15] https://www.ncbi.nlm.nih.gov/pubmed/20672327/
[16] https://www.ncbi.nlm.nih.gov/pubmed/24232446/
[17] https://www.ncbi.nlm.nih.gov/pubmed/21440011/
[18] https://www.ncbi.nlm.nih.gov/pubmed/21127245
[19] https://www.ncbi.nlm.nih.gov/pubmed/25080109/
[20] https://www.ncbi.nlm.nih.gov/pubmed/19357233/
[21] https://www.ncbi.nlm.nih.gov/pubmed/23863160
[22] https://www.ncbi.nlm.nih.gov/pubmed/22436748/
[23] https://www.ncbi.nlm.nih.gov/pubmed/18497260
[24] https://www.ncbi.nlm.nih.gov/pubmed/18840363
[25] https://www.ncbi.nlm.nih.gov/pubmed/26449471/
[26] https://www.ncbi.nlm.nih.gov/pubmed/26262692/
[27] https://www.ncbi.nlm.nih.gov/pubmed/23732640/
[28] https://www.ncbi.nlm.nih.gov/pubmed/21737445/
[29] https://www.ncbi.nlm.nih.gov/pubmed/23900420/
[30] https://www.ncbi.nlm.nih.gov/pubmed/18048590/
[31] https://www.ncbi.nlm.nih.gov/pubmed/24959196/
[32] https://www.ncbi.nlm.nih.gov/pubmed/23470307
[33] https://www.ncbi.nlm.nih.gov/pubmed/19474060
[34] https://doi.org/10.1016/j.bbcan.2014.10.007
[35] http://science.sciencemag.org/content/335/6076/1638
[36] https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4783224/
[37] https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4816127/
[38] https://www.ncbi.nlm.nih.gov/pubmed/15365568
[39] https://doi.org/10.1038/nrm3025
[40] https://doi.org/10.1016/j.brainres.2007.06.075
[41] https://doi.org/10.1016/j.bbr.2008.02.016
[42] https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1356109
[43] https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3784301/
[44] https://doi.org/10.1242/dev.01255
[45] https://doi.org/10.1242/dev.01255
[46] https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2887462
[47] https://www.ncbi.nlm.nih.gov/pubmed/22870349
[48] https://www.ncbi.nlm.nih.gov/pubmed/22870349
[49] https://www.ncbi.nlm.nih.gov/pubmed/24353195
[50] https://www.ncbi.nlm.nih.gov/pubmed/15878852
[51] http://jcb.rupress.org/content/206/2/173
[52] https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3467268/
[53] https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3076631/
[54] https://www.ncbi.nlm.nih.gov/pubmed/15494402
[55] https://www.sciencedirect.com/science/article/pii/S1084952114002535
[56] https://www.ncbi.nlm.nih.gov/pubmed/19818818
[58] http://www.pnas.org/content/111/4/E435
[59] https://www.nature.com/articles/nrd2062
[60] https://www.ncbi.nlm.nih.gov/pubmed/20851890
[61] https://www.ncbi.nlm.nih.gov/pubmed/16550606/
[62] https://www.ncbi.nlm.nih.gov/pubmed/23468988
[63] https://www.ncbi.nlm.nih.gov/pubmed/21520297
[64] https://bmccomplementalternmed.biomedcentral.com/articles/10.1186/1472-6882-12-160
[65] https://www.ncbi.nlm.nih.gov/pubmed/21042741
[66] https://academic.oup.com/carcin/article/34/12/2814/2464142
[67] https://www.ncbi.nlm.nih.gov/pubmed/23895284
[68] https://www.ncbi.nlm.nih.gov/pubmed/21246613
[69] https://www.ncbi.nlm.nih.gov/pubmed/24799956
[70] https://doi.org/10.1111/apha.12532
[71] https://linkinghub.elsevier.com/retrieve/pii/S0098299715300212
[72] http://www.jbc.org/content/285/20/15611?ijkey=9e855a0b37a34705c6fd1e0b385b816621487efa&keytype2=tf_ipsecsha
[73] https://www.ncbi.nlm.nih.gov/pubmed/18064042?dopt=Abstract
[74] https://www.sciencedirect.com/science/article/pii/S0092867412003510
[75] http://www.pnas.org/content/110/31/12526
[76] https://www.ncbi.nlm.nih.gov/pubmed/8940145
[77] https://doi.org/10.1016/j.tins.2009.11.003
[78] https://doi.org/10.1016/j.neurobiolaging.2016.01.004
[79] https://www.sciencedirect.com/science/article/pii/S1084952114002535
[80] https://www.ncbi.nlm.nih.gov/pubmed/23399656
[81] https://www.ncbi.nlm.nih.gov/pubmed/21179166
[82] https://www.ncbi.nlm.nih.gov/pubmed/188403